提速小麥單倍體技術(shù)產(chǎn)業(yè)化進(jìn)程——原創(chuàng )小麥單倍體花青素標記鑒別系統
日期:2023-03-08 17:31:35
小麥是世界上最重要的糧食作物之一��,為人類(lèi)提供約20%的食物熱量��。隨著(zhù)全球人口的增加���,2050年小麥產(chǎn)量需要提高70%�����,培育優(yōu)良品種是提高產(chǎn)量的有效途徑�。然而����,使用傳統方法非常耗時(shí)�,培育一個(gè)新的小麥品種通常需要至少8-10年��。但通過(guò)雙單倍體(Doubled Haploid��,DH)育種技術(shù)的運用���,純系只需1-2個(gè)世代即可產(chǎn)生�,顯著(zhù)縮短育種周期��,大大加快了育種進(jìn)程�����。DH系生產(chǎn)包括3個(gè)環(huán)節�,即單倍體誘導 ��、單倍體加倍和DH系繁殖與鑒定����,每個(gè)環(huán)節都對純系的生產(chǎn)效率至關(guān)重要�。
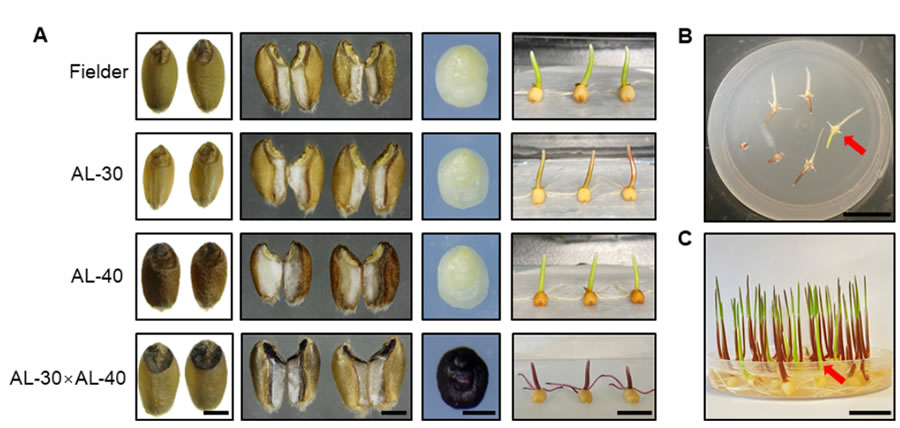
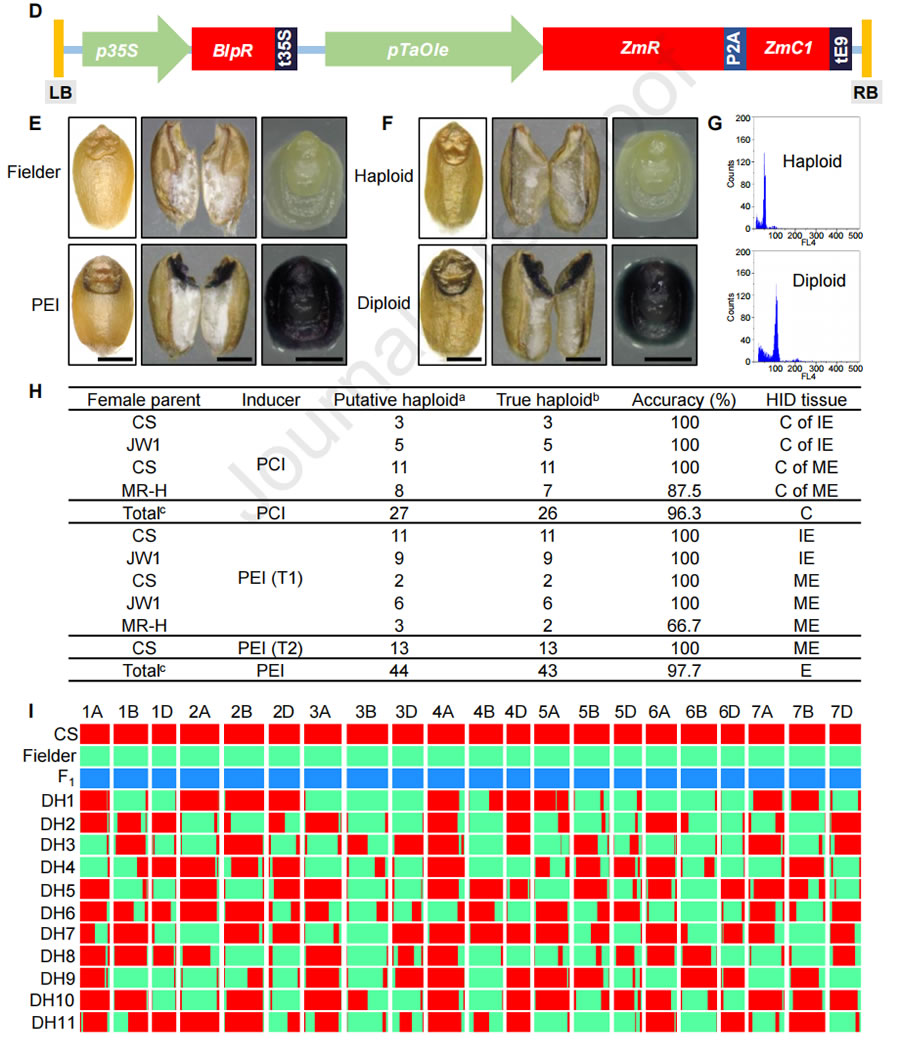
在小麥單倍體誘導環(huán)節���,前期中國農業(yè)大學(xué)團隊研究團隊通過(guò)敲除玉米單倍體誘導關(guān)鍵基因ZmPLA1的同源基因��,率先在小麥中建立了單倍體誘導(haploid induction, HI) 技術(shù)體系�,單倍體誘導效率高于20%��。小麥單倍體技術(shù)體系雖有了高效的誘導技術(shù)�����,但是該技術(shù)的應用仍需解決小麥單倍體鑒別等問(wèn)題�,開(kāi)發(fā)高效的標記是實(shí)現小麥單倍體鑒別(haploid identification, HID) 的核心��。2023年3月1日���, Plant Communications在線(xiàn)發(fā)表了中國農業(yè)大學(xué)陳紹江����、劉晨旭團隊題為“Establishment of an efficient haploid identification system by engineering anthocyanin accumulation in wheat embryo”��,該研究利用玉米花青素調控基因ZmC1和ZmR����,成功創(chuàng )制了小麥紫胚芽鞘誘導系PCI和紫胚誘導系PEI����,實(shí)現了小麥單倍體的精準鑒別�,并利用PEI誘導系成功創(chuàng )制了DH系��,展現了該技術(shù)在小麥育種中的應用前景��。前人研究表明ZmC1和ZmR可以調控植物花青素合成�����,中國農業(yè)大學(xué)研究團隊為了測試使用ZmC1和ZmR進(jìn)行小麥HID的可行性��,評估了轉基因品系AL-30和AL-40的色素沉著(zhù)情況���,這些品系分別含有pUbi驅動(dòng)的ZmC1和pUbi驅動(dòng)的ZmR����。AL-30和AL-40在胚胎和種皮分別出現色素沉著(zhù)(圖1A)��。除此以外����,在胚胎或胚乳中沒(méi)有發(fā)現AL-30�����、AL-40和野生型之間的差異���。接下來(lái)��,通過(guò)將AL-30和AL-40雜交�����,研究團隊創(chuàng )造了一個(gè)同時(shí)具有ZmC1和ZmR的F1����。結果表明��,成熟的胚胎(ME)�����,未成熟的胚胎(IE)和F1果核的外胚層都顯示出深紫色色素��,表明ZmC1和ZmR能協(xié)同促進(jìn)花青素的積累(圖1A)����。然而�����,ZmC1和ZmR的同時(shí)過(guò)表達也導致導致葉片強烈的色素沉著(zhù)�,嚴重阻礙了幼苗的生長(cháng)��,最終導致死亡�。因此��,不能簡(jiǎn)單地將pUbi驅動(dòng)的ZmC1和ZmR用于小麥的HID�����。研究團隊將組成型表達ZmC1的材料AL-30與誘導系進(jìn)行雜交���,通過(guò)分子標記與表型輔助選擇�,育成了紫胚芽鞘誘導系PCI��。利用該誘導系雜交的后代�����,根據胚芽鞘顏色可實(shí)現單倍體精準鑒別(圖1B-C)����,單倍體鑒別準確率為96.3%(圖1G-H)���。圖1 中國農業(yè)大學(xué)研究團隊建立的高效小麥HID系統為了在種子階段實(shí)現可視化的HID��,研究團隊確定了一個(gè)胚胎偏好的啟動(dòng)子Oleosin-like基因—TaOle��。TaOle的1419bp啟動(dòng)子片段與ZmR和ZmC1的CDS融合��,構成pTaOle驅動(dòng)的ZmR-P2A-ZmC1表達載體(圖1D)��。將該載體被轉化到小麥單倍體誘導系TaPLA-4A和TaPLA-4D中��,結果表明所有四個(gè)陽(yáng)性轉基因植株在IE和ME中都顯示出深紫色的色素沉著(zhù)����,但在其他組織中沒(méi)有染色��,表明pTaOle在轉基因植物的胚胎中工作良好(圖1E)���。更重要的是����,這些轉基因植物的生長(cháng)和發(fā)育沒(méi)有受到影響����,這是對AL-30和AL-40的F1雜種的巨大改良����。在T1代中����,具有ZmR-P2A-Zm純合基因型的個(gè)體被篩選并命名為紫色胚胎誘導系(PEI)�����。為了測試HID的性能�,我們用CS����、JW1和MR-H的胚胎供體植物與花粉來(lái)自同源的T1 PEI植物的花粉雜交����。根據IE和ME中色素沉著(zhù)的缺失情況����,篩選出推測的單倍體(圖1F)����,并通過(guò)流式細胞儀和表型進(jìn)一步驗證(圖1G)����。在IE階段����,有11個(gè)和9個(gè)推定的單倍體分別來(lái)自CS和JW1�����,后被驗證為真正的單倍體����;在ME階段��,有2個(gè)���、6個(gè)和3個(gè)假定的單倍體分別來(lái)自CS���、JW1和MR-H�����。倍性分析的結果顯示分析結果顯示�����,只有MR-H的一個(gè)推定單倍體被發(fā)現是二倍體(6N)�。為了進(jìn)一步評估HID的準確性�,在T2代中篩選了13個(gè)假定的CS單倍體��,所有這些都被證實(shí)是真正的單倍體����。因此�,在IE和ME階段的總體HID準確性為97.7%(圖1H)�����。同樣的方法用于驗證18個(gè)假定的二倍體(6N)的紫色胚胎����,所有這些胚胎都被確認為真正的二倍體(6N)�����。上述結果表明����,PEI可以實(shí)現小麥的高效HID��。此外�,研究團隊將F1雜交種(CS×Fielder)與PEI雜交��,產(chǎn)生單倍體用于染色體加倍���?�?偣搏@得11個(gè)單倍體��,所有的單倍體在秋水仙素處理后都加倍了�。為了研究DH是否在所有的染色體上都是純合的��,用靶向測序技術(shù)對11個(gè)DH的基因組進(jìn)行了基因分型�。9158個(gè)單核苷酸多態(tài)性(SNPs)的生物信息學(xué)分析顯示���,沒(méi)有一個(gè)DH攜帶雜合的位點(diǎn)(圖1I)��,表明PEI可以誘導純合子���,并可能成為小麥DH育種的一個(gè)前景廣闊的工具����。該研究原創(chuàng )的小麥單倍體花青素標記鑒別系統��,為新型小麥單倍體育種技術(shù)從理論研究到實(shí)踐應用邁出了一大步��,提速小麥單倍體技術(shù)產(chǎn)業(yè)化的進(jìn)程����,對于加快小麥育種進(jìn)程具有里程碑式的意義��。綜上所述�����, DH育種因具備周期短���、純度高等優(yōu)點(diǎn)��,獲得了國內外各大農業(yè)公司及育種單位的密切關(guān)注��。對于種業(yè)公司來(lái)說(shuō)�����,早日推出優(yōu)異新品種就可以早日獲取效益����,而對于育種家們來(lái)說(shuō)���,縮短育種周期��、加快育種速度是他們畢生的奮斗目標��。隨著(zhù)單倍體誘導關(guān)鍵調控基因的進(jìn)一步挖掘和基因編輯技術(shù)的聯(lián)合使用�����, DH育種技術(shù)已經(jīng)不僅僅局限在玉米純系的創(chuàng )制上����,其應用也由玉米拓展到單子葉作物水稻�、小麥����、谷子���,以及雙子葉擬南芥�����、蒺藜苜蓿�����、番茄����、煙草等多種植物上���,未來(lái) DH育種技術(shù)在作物育種和改良上將發(fā)揮更大的作用�,糧食作物以及蔬菜經(jīng)濟作物工廠(chǎng)化應用將很快到來(lái)�����。
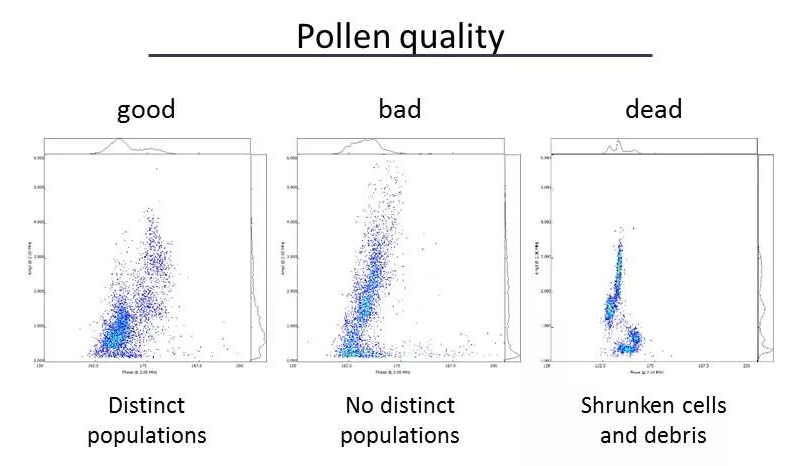
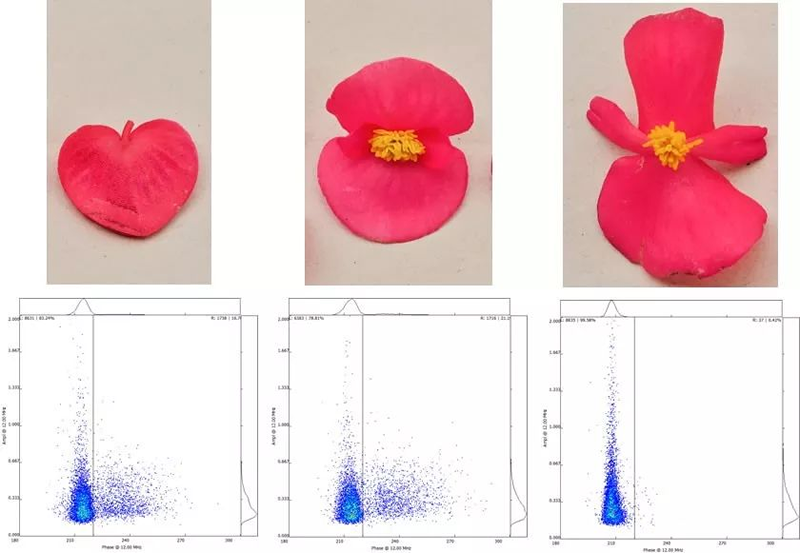
實(shí)驗室-溫室-田間的一體化DH生產(chǎn)服務(wù)北大荒墾豐種業(yè)-澤泉科技生物技術(shù)與表型服務(wù)中心是由北大荒墾豐種業(yè)股份有限公司和上海澤泉科技股份有限公司共同建設的開(kāi)放式高通量植物基因型-表型-育種服務(wù)平臺��。中心建立了基因克隆和載體平臺����、作物轉化系統�����、基因型分析平臺��、表型鑒定分析平臺���、數據分析和利用平臺等現代化生物技術(shù)和信息支持平臺�����,是定位于為植物科研和作物育種提供植物基因型-表型-育種數據分析的科研服務(wù)平臺����。為了縮短您的育種進(jìn)程����,提高您的育種成功率����,北大荒墾豐種業(yè)澤泉科技生物技術(shù)與表型服務(wù)中心將為您提供一體化DH生產(chǎn)服務(wù)�。我們提供DH服務(wù)技術(shù)流程:從實(shí)驗室——溫室——田間一體化服務(wù)����。父本誘導系誘導母本材料����,孤雌生殖�����,產(chǎn)生單倍體種子(幼胚)�。20-60份/皿���。置于人工培養室(帶光照層架)或人工培養箱中培養48小時(shí)左右�����。將幼胚在體視熒光顯微鏡下觀(guān)察或者在日光燈下觀(guān)察�,以自交系所得幼胚為對照��。因為雜合二倍體含有父本基因����,所以單倍體有微弱熒光或無(wú)色�。將挑選的擬單倍體直接置于含有加倍藥劑(秋水仙素)的MS培養基上���,暗培養��;后轉入不含加倍藥劑的MS培養基�,暗培養后光照培養����,待幼苗2葉一心時(shí)移至培養瓶中(MS培養基)�����。將培養瓶中DH系幼苗在4葉一心時(shí)移栽至苗缽���,在溫室中煉苗���。待幼苗5-6葉期移栽至溫室花盆或大田�����,待散粉時(shí)�,及時(shí)套袋進(jìn)行自交授粉���。田間收獲和鑒別�。如果用采用花藥離體培養單倍體的方法����,則省去觀(guān)察幼胚的步驟����,其余步驟基本相同����。花粉作為一種重要的種質(zhì)資源���,被廣泛利用到科學(xué)研究��、新品繁育�����、農業(yè)研究�����、種子生產(chǎn)等領(lǐng)域中�。通常�,花粉容易受到光照���、溫度��、濕度等環(huán)境因素的影響�,因此花粉活力檢測是育種和農業(yè)生產(chǎn)過(guò)程中必不可少的檢測指標���。篩選高活性的花粉進(jìn)行授粉可以提高作物結籽率��、果品品質(zhì)�,提高產(chǎn)量預測的準確性�,進(jìn)而減少農業(yè)生產(chǎn)過(guò)程中不必要的損失��。傳統上進(jìn)行花粉活力檢測主要通過(guò)染色法和體外萌發(fā)法���,然而這兩種方法費時(shí)耗力����、通量低����、適用性及統計性差����,往往不能滿(mǎn)足育種��、生產(chǎn)過(guò)程中的日常需求��?;ǚ刍盍Ψ治鰞x通過(guò)檢測流經(jīng)交流電場(chǎng)的花粉顆粒的電阻抗特性���,實(shí)時(shí)獲取大量花粉顆粒的大小���、活性���、濃度等數據���。該方法已應用于上百種植物花粉活性的檢測�,是一種高效�����、可靠且標準化的檢測技術(shù)����。澤泉科技AgriPheno平臺已引進(jìn)Ampha? Z40花粉活力分析儀并向廣大育種家和農業(yè)生產(chǎn)者推出花粉活力的檢測分析服務(wù)����。DH育種是利用誘導系誘導(或花藥離體培養等手段誘導)產(chǎn)生單倍體植株�,再通過(guò)染色體組加倍(自然加倍或藥劑處理)使植物恢復正常染色體數的育種方法����。由于自然單性生殖或孤雄生殖單倍體非常罕見(jiàn)��,因此單倍體的獲得成為單倍體育種的一個(gè)難點(diǎn)���,游離小孢子培養是獲得單倍體的重要手段之一�����?���;ǚ刍盍Ψ治鰞x(阻抗流式細胞技術(shù)�,IFC)可以在DH育種過(guò)程中�,幫助選擇小孢子植物供體��,評估小孢子胚誘導策略����,優(yōu)化培養條件�,并在小孢子培養早期進(jìn)行產(chǎn)胚量的準確預測���,可顯著(zhù)提高游離小孢子培養的成功率����,進(jìn)而加快DH育種的效率����。花粉的形成受到遺傳因素的嚴格控制����,而當控制花粉發(fā)育的基因發(fā)生突變時(shí)將導致花粉質(zhì)量降低�����、花粉數量減少或是完全沒(méi)有花粉�。雜交育種過(guò)程中����,花粉敗育的雄性不育系是理想的母本���,而任意環(huán)境下具備大量高活性花粉的雄性可育系則是理想的父本�。不同品種的蘋(píng)果花粉的活性(含熱滅活對照)優(yōu)化花粉發(fā)育條件�����,篩選優(yōu)質(zhì)��、高抗品種花粉活性通常會(huì )受到光���、熱溫度�、農藥等環(huán)境因素的影響�����,可以通過(guò)不同條件下花粉的活性來(lái)確定花粉生長(cháng)的理想條件�����,或篩選優(yōu)質(zhì)���、高抗品系�。下圖為五種不同植物花粉對溫度變化的響應����,如圖所示��,某些花粉是可以暴露在50℃的高溫下的(粉色)����,而其他花粉則在45℃就逐漸失活����。這表明每一種花粉都有其理想的生長(cháng)溫度��,獲得高活性花粉不能超過(guò)其理想生長(cháng)溫度�。確定花粉采集時(shí)間��、優(yōu)化花粉儲存條件育種和生產(chǎn)過(guò)程中��,通常會(huì )遇到花期不育的問(wèn)題��,這就需要提前采集花粉�����,保存備用�。但自然條件下���,絕大多數植物花粉的壽命都較短��,而且容易受溫度���、光照等因素的影響�,因此���,何時(shí)收獲花粉���,收獲后如何保存并維持花粉的活力則至關(guān)重要����。未開(kāi)放的花苞(左)和剛剛開(kāi)放的花朵(中)��,花粉具備活性����,當花蕊完全伸展后(右)��,花粉則不再具備活性��。真菌孢子細胞與花粉粒具有高度相似性����,因此也可以進(jìn)行類(lèi)似的活性檢測����,目前已檢測過(guò)的細胞有細菌�、酵母����、藻類(lèi)�、動(dòng)物�����、人體等單細胞����。下圖為不同來(lái)源的酵母活性的對比���,如圖所示�����,鮮酵母活性較高����;�����,而干燥酵母��,即使于室溫下培育1小時(shí)�����,它的活性仍然比新鮮酵母低����;取自啤酒的酵母細胞活性較差��。如您需要了解更多信息�����,請點(diǎn)擊或掃描下方二維碼填寫(xiě)登記表����,我們會(huì )為您提供專(zhuān)業(yè)的服務(wù)����,真誠期待與您的合作����!